|
碳納米管修飾電極電催化還原去除廢水中的氯霉素氯霉素具有良好的抗菌作用和藥物代謝動(dòng)力學(xué)特性,在控制和治療家畜、 家禽、 蜜蜂和水生動(dòng)物的傳染性疾病中發(fā)揮了重要作用[1, 2]. 但是,氯霉素能夠抑制人體骨髓造血功能,引起再生障礙性貧血,甚至誘發(fā)癌癥[3]. 為此,美國、 歐盟等國家和組織將氯霉素列為違禁藥物,規定不得在動(dòng)物源性食品中檢出,我國也于2002年規定在動(dòng)物疫病防治中禁止使用氯霉素. 由于氯霉素的廣譜抗菌作用,使用方便且價(jià)格低廉,被非法使用的現象時(shí)有發(fā)生[4]. 氯霉素可以通過(guò)動(dòng)物排泄、 污廢水排放和降雨徑流等途徑進(jìn)入水環(huán)境,并持續污染水體,在海水[5]、 城市污水[6, 7]、 養豬場(chǎng)廢水[8]和污水處理廠(chǎng)出水[9, 10]中均能檢出氯霉素的存在. 水環(huán)境中的氯霉素不僅能使細菌產(chǎn)生抗性基因,還可通過(guò)食物鏈進(jìn)入人體,嚴重威脅生態(tài)環(huán)境安全和人體健康. 因此,發(fā)展廢水中氯霉素的有效去除方法顯得極其重要. 目前,廢水中氯霉素的去除方法主要有傳統處理法(聚沉、 絮凝和微生物降解等)[11]、 吸附法[12]、 臭氧氧化法[13]、 輻射與光分解法[14, 15]、 Fenton氧化法[16]等,但是,這些方法存在處理效率低、 投資大、 能耗高或容易造成二次污染等問(wèn)題. 電化學(xué)法包括電氧化法和電還原法,具有高效、 低成本、 操作簡(jiǎn)便和環(huán)境友好等特點(diǎn),電氧化法已用于酚類(lèi)化合物和染料廢水的處理研究[17]. 但是,電氧化處理有機物通常需要較高的氧化電位,氧化電位過(guò)高不僅增加能耗,嚴重腐蝕電極,還會(huì )加劇析氧、 析氯等副反應. 近年來(lái),電還原處理抗生素顯現出一定的潛力,孫飛等[18]和Liang等[19]用非生物陰極還原氯霉素,處理24 h時(shí)的去除率分別達到57.9%與73.0%,但是這些方法的處理能力受到電極材料的制約. 碳納米管具有長(cháng)徑比和比表面積大、 穩定性強和量子效應明顯等特性,用做修飾材料可以降低電極的過(guò)電勢,增加電流響應,提高電極的選擇性和靈敏度,現在主要用于氯霉素的測定研究[20, 21],鮮見(jiàn)用于去除廢水中氯霉素的報道. 由于缺乏有效的試劑分散碳納米管,通常將碳納米管直接超聲分散在純水中,造成成膜效果不理想,影響修飾電極的電催化活性. 表面活性劑同時(shí)具有親水和疏水性質(zhì),能夠將碳納米管有效地分散在水中[22]. 為此,本研究在篩選表面活性劑的基礎上,優(yōu)化碳納米管與表面活性劑的配比、 分散液修飾量,制備碳納米管修飾電極,分析修飾電極對模擬廢水中氯霉素的去除能力,初步探討氯霉素的還原去除機制,以期為發(fā)展廢水中抗生素的處理技術(shù)、 保護水環(huán)境質(zhì)量提供科學(xué)依據. 1 材料與方法 1.1 主要試劑 氯霉素標準品(分析純,純度 ≥ 98.5%)購自德國Dr. Ehrenstorfer公司; 乙腈和甲醇均為色譜純,購自Fisher Scientific公司; 雙十六烷基磷酸(DHP)購自上海將來(lái)生化試劑公司,十二烷基硫酸鈉(SDS)和十六烷基三甲基溴化銨(CTAB)均購自成都科龍化學(xué)試劑公司; 其余試劑均為分析純,購自成都科龍化學(xué)試劑公司. 羧基化多壁碳納米管(MWCNTs): 純度>95%,管徑為8~15 nm,長(cháng)度為0.5~2 μm,南京先豐納米材料科技有限公司生產(chǎn). 含氯霉素的模擬廢水: 準確稱(chēng)取1 g氯霉素(純度為96%,合肥博美生物科技有限公司),加入100 mL甲醇溶解,用去離子水稀釋至1000 mL,配制成質(zhì)量濃度為1000 mg·L-1的貯備溶液,于4℃避光保存. 臨用前根據需要,取氯霉素貯備液,用不同電解質(zhì)溶液(0.1 mol·L-1 HAc-NaAc、 Na2SO4、 NH3·H2O-NH4Cl、 Na2HPO4-NaH2PO4溶液)稀釋?zhuān)渲瞥少|(zhì)量濃度為1、 2、 5、 10 mg·L-1的氯霉素工作溶液. 1.2 主要儀器 電化學(xué)工作站: CHI 660E型,上海辰華儀器有限公司,工作電極為碳納米管修飾的玻碳電極(直徑3 mm),對電極為鉑絲電極(直徑1 mm),參比電極為飽和甘汞電極(SCE); 掃描電子顯微鏡(SEM): JSM-7800F型,日本電子株式會(huì )社; 激光粒度與Zeta電位分析儀: ZetaPlus型,美國B(niǎo)rookhaven儀器公司; 高效液相色譜分析儀: LC-20A型,配SPD-20A紫外檢測器,日本Shimadazu公司; 液相色譜-串聯(lián)質(zhì)譜分析儀: API 4000型,美國AB SCIEX公司. 1.3 實(shí)驗步驟與方法1.3.1 碳納米管修飾電極的制備 電極的預處理: 在麂皮上用Al2O3粉末(粒徑為0.3 μm)將玻碳電極(GCE)表面拋光成鏡面,依次用超純水、 無(wú)水乙醇和超純水超聲清洗,每次清洗5 min. 碳納米管的分散: 取適量MWCNTs粉末和表面活性劑,加入超純水,超聲分散20 min,獲得均勻的碳納米管分散液(1 mg·mL-1),4℃密封保存備用. 修飾電極的制備: 取適量碳納米管分散液,均勻滴涂到處理好的GCE表面,室溫下風(fēng)干待用. 1.3.2 模擬廢水中氯霉素的電催化還原 分別移取5 mL質(zhì)量濃度為1、 2、 5、 10 mg·L-1的氯霉素溶液于電解池(直徑約1.5 cm、 高約4 cm)中,錫箔紙覆蓋后置于磁力攪拌器上,室溫恒速攪拌,浸入碳納米管修飾電極、 鉑絲電極和飽和甘汞電極,在時(shí)間-電流法模式下電催化還原氯霉素. 取還原12 h的反應液1 mL,過(guò)0.22 μm有機濾膜,用高效液相色譜法(HPLC)測定氯霉素含量,計算氯霉素的去除率. 每個(gè)實(shí)驗重復3次,下同. 實(shí)驗結束,取出碳納米管修飾電極,置于0.1 mol·L-1 NH3·H2O-NH4Cl溶液,在偏壓為1.5 V下去鈍化30 min,對電極進(jìn)行再生. 1.3.3 表面活性劑的篩選和電極修飾條件優(yōu)化 取DHP、 SDS和CTAB等3種表面活性劑,分別與MWCNTs混合,加入超純水并超聲分散20 min,于4℃下靜置,觀(guān)察MWCNTs在超純水中的穩定情況; 取MWCNTs分散液1 mL,測定Zeta電位,篩選出輔助分散效果最好的表面活性劑. 按照1.3.1節的步驟,以MWCNTs與表面活性劑的配比分別為1∶2、 1∶1和2∶1,分散液修飾量分別為5、 10、 15、 20和25 μL,制備碳納米管修飾電極,考察修飾電極電催化還原2 mg·L-1氯霉素的效果. 1.3.4 電催化還原條件的優(yōu)化 按照1.3.2節的實(shí)驗步驟,考察偏壓、 底液、 初始pH對2 mg·L-1氯霉素去除率的影響,其中偏壓為-0.6、 -0.7、 -0.8、 -0.9、 -1.0、 -1.1和-1.2 V,底液為0.1 mol·L-1 HAc-NaAc、 Na2SO4、 NH3·H2O-NH4Cl和Na2HPO4-NaH2PO4溶液,初始pH為4、 5、 6、 7、 8、 9和10. 1.3.5 電催化還原氯霉素的動(dòng)力學(xué)特征 移取5 mL質(zhì)量濃度為2 mg·L-1的氯霉素溶液于電解池中,用錫箔紙覆蓋避光,置于磁力攪拌器,室溫恒速攪拌,在最優(yōu)實(shí)驗條件下分別還原2、 4、 6、 8、 10、 12、 14、 16、 18、 20、 22和24 h,取反應液1 mL,過(guò)0.22 μm有機濾膜,測定濾液中氯霉素含量,研究電催化還原氯霉素的動(dòng)力學(xué)特征. 1.3.6 氯霉素及其還原產(chǎn)物的測定與質(zhì)量控制 采用HPLC分離、 紫外檢測器測定氯霉素的含量[23]. 色譜柱: Inertsil ODS-SP色譜柱(250 mm×4.6 mm; 5 μm),柱溫為30℃; 流動(dòng)相為20%乙腈-水溶液,流速為0.8 mL·min-1,等度洗脫; 進(jìn)樣量為20 μL. 通過(guò)紫外全波長(cháng)掃描,確定檢測波長(cháng)為274 nm. 外標法定量,獲得氯霉素的檢出限為9.6 μg·L-1,在7個(gè)加標水平的回收率為80.15%~106.8%,相對標準偏差(RSD)為5.17%~9.86%. 采用液相色譜-串聯(lián)質(zhì)譜法(LC-MS/MS)鑒定氯霉素的還原產(chǎn)物. 色譜條件: Acquity UPLC BEH C18色譜柱(100 mm×2.1 mm,1.7 μm,Waters),柱溫為40℃; 流動(dòng)相為55%甲醇-水溶液,流速為0.3 mL·min-1; 進(jìn)樣量為5 μL. 質(zhì)譜條件: 碰撞氣為氬氣,錐孔氣和霧化氣均為高純氮氣; 負離子化模式,噴霧電壓為4500 V,溫度為550℃; 全掃描模式監測. 2 結果與討論2.1 碳納米管修飾電極的制備條件2.1.1 表面活性劑的篩選 考察了在SDS、 CTAB和DHP等3種表面活性劑作用下,碳納米管在超純水中的分散效果. 在SDS和CTAB作用下,MWCNTs分散液分別放置27 d和45 d基本沉降完全; 在DHP作用下,MWCNTs分散液放置3個(gè)月未發(fā)現沉降現象. 結果表明,DHP是碳納米管的一種有效助散劑,使得碳納米管在純水中分散均勻、 性質(zhì)穩定. 從分子結構上來(lái)看,SDS分子中含有一條12個(gè)碳原子的疏水長(cháng)鏈,CTAB分子中含有一條16個(gè)碳原子的疏水長(cháng)鏈,而DHP分子中含有兩條16個(gè)碳原子的疏水長(cháng)鏈,使得3種表面活性劑的疏水性表現為DHP>CTAB>SDS,在超聲時(shí)DHP能夠促使碳納米管被均勻分散到純水中,形成更加穩定的懸浮液[20]. Zeta電位分析發(fā)現,SDS、 CTAB和DHP輔助分散的碳納米管懸浮液的Zeta電位分別為-28.10、 -31.26和-40.18 mV. Zeta電位的絕對值越大,膠體粒子表面所帶的同種電荷越多,使得膠體粒子越分散,在DHP作用下膠體粒子的穩定性最強,因此選用DHP輔助分散碳納米管. 2.1.2 MWCNTs和DHP的配比 考察了MWCNTs和DHP的配比對修飾電極電催化還原氯霉素的影響. 當MWCNTs和DHP的配比為1∶2、 1∶1和2∶1時(shí),電催化還原12 h時(shí)氯霉素的去除率分別達到72.96%、 82.25%和75.83%,說(shuō)明MWCNTs和DHP的配比為1∶1時(shí)氯霉素的去除率最高. 分散液中MWCNTs和DHP的配比過(guò)低或過(guò)高都不利于氯霉素的還原,這是因為DHP本身不導電[21],當DHP的占比高時(shí),阻礙電子傳遞; 當DHP的占比低時(shí),MWCNTs不能充分分散在超純水中,部分MWCNTs發(fā)生沉降,使得修飾到GCE表面的碳納米管相對較少,降低了氯霉素的還原率. 因此,確定MWCNTs和DHP的配比為1∶1. 2.1.3 分散液修飾量 考察了分散液修飾量對修飾電極電催化還原氯霉素的影響. 在電催化還原12 h時(shí),氯霉素的去除率隨電極上分散液修飾量的增加而逐漸增加; 當修飾量為15 μL時(shí),氯霉素的去除率達到最大(82.25%); 隨后去除率隨修飾量的增加而逐漸減小. 這是因為隨著(zhù)分散液修飾量的增加,GCE表面的活性位點(diǎn)增加,加快了電子傳遞,有利于氯霉素的還原; 當修飾量超過(guò)15 μL時(shí),會(huì )使GCE表面的碳納米管變厚,阻礙電子在溶液與電極間傳遞,導致氯霉素的還原率下降. 因此,確定分散液修飾量為15 μL. 2.2 碳納米管修飾電極的表征 圖 1表示DHP和MWCNTs/DHP的掃描電鏡圖. 從中可以看出,未超聲分散的DHP為塊狀和片狀晶體[圖 1(a)]; 超聲分散的MWCNTs/DHP復合物具有明顯的碳納米管形態(tài)結構[圖 1(b)],碳納米管相互纏繞,其間夾雜著(zhù)小塊狀的DHP晶體,與DHP單體具有顯著(zhù)差異.  圖 1 DHP和MWCNTs/DHP的掃描電鏡圖 圖 2為碳納米管修飾電極和裸GCE在含有5mmol·L-1 K3[Fe(CN)6]的0.1 mol·L-1 KCl溶液中的循環(huán)伏安圖. 從中可以看出,碳納米管修飾電極的氧化峰電流(120 μA)遠大于裸GCE(58 μA),還原峰電流(127 μA)也遠大于裸GCE(69 μA),表明修飾碳納米管后有利于電子在溶液和電極間傳導,具有優(yōu)良的電催化潛力,也證實(shí)碳納米管被成功修飾到GCE上. 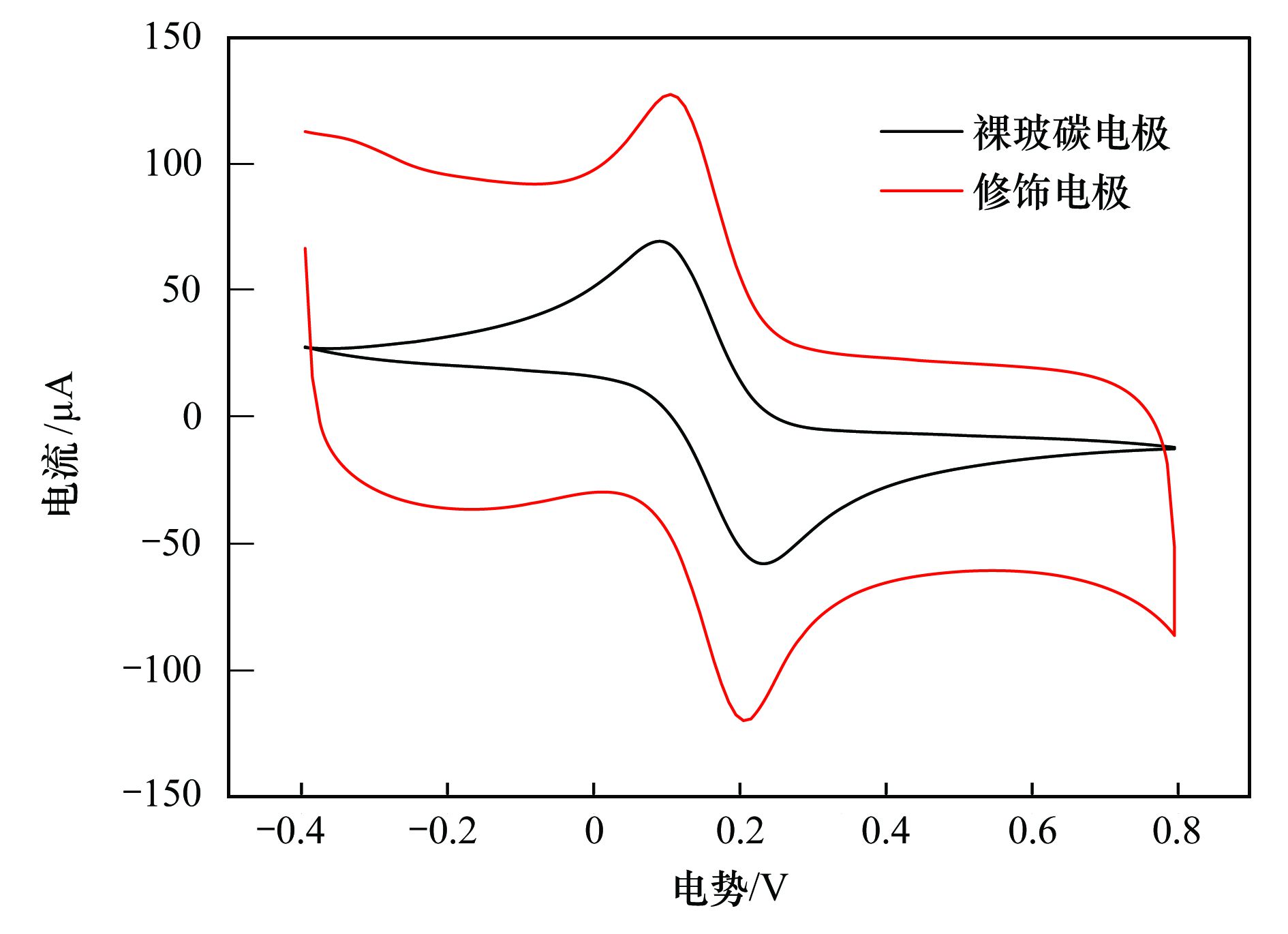 圖 2 碳納米管修飾電極和裸玻碳電極的循環(huán)伏安圖 2.3 氯霉素的電催化還原條件2.3.1 偏壓 利用電化學(xué)工作站輸出額定偏壓,研究偏壓對電催化還原氯霉素的影響,獲得的結果如圖 3所示. 從中可以看出,隨著(zhù)偏壓的增加,氯霉素的去除率逐漸升高,當偏壓為-1.2 V時(shí),氯霉素的去除率達到86.59%. 有研究指出,陰極電位越負,作為電子受體的污染物還原效率越高[24]. 但是,在偏壓為-1.2 V時(shí)工作電極表面有大量氣泡產(chǎn)生,其原因可能是過(guò)電勢增大使得電極表面發(fā)生了析氫反應; 當偏壓為-1.1 V時(shí),工作電極表面未觀(guān)察到氣泡產(chǎn)生,氯霉素的去除率達到82.25%. 為了避免析氫反應和減少能耗,本研究確定偏壓為-1.1 V. 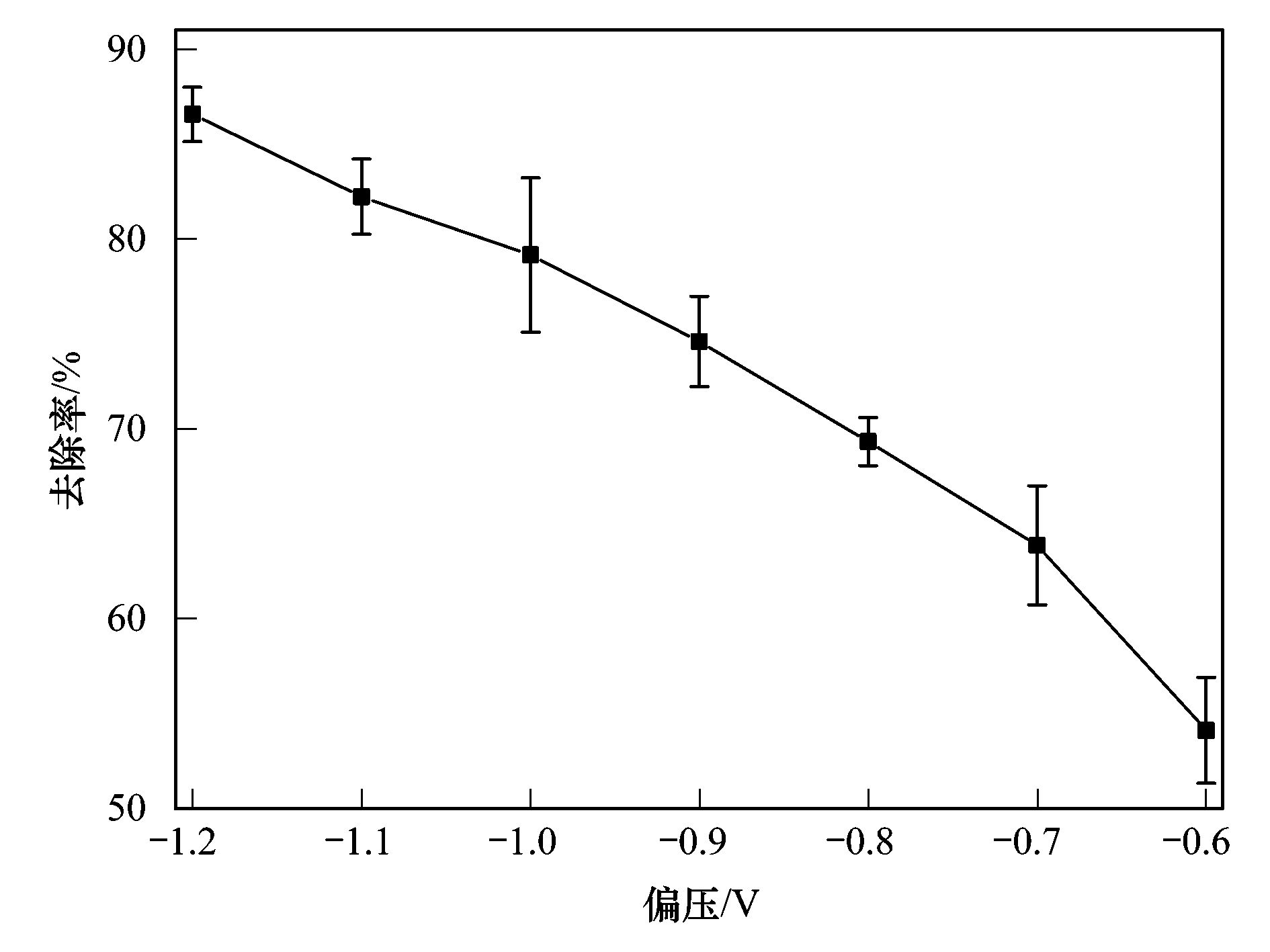 圖 3 偏壓對電催化還原氯霉素的影響 2.3.2 底液 在偏壓為-1.1 V時(shí),考察了底液對電催化還原氯霉素的影響. 有研究發(fā)現,在初始pH為7的0.1 mol·L-1的HAc-NaAc、 Na2SO4、 NH3·H2O-NH4Cl、 Na2HPO4-NaH2PO4溶液中,氯霉素的去除率分別為56.32%、 68.78%、 82.25%和70.13%,說(shuō)明在NH3·H2O-NH4Cl溶液中更有利于氯霉素的還原. 張金磊等[25]用循環(huán)伏安法測定氯霉素時(shí),也發(fā)現在NH3·H2O-NH4Cl溶液中氯霉素的還原峰電流最大. 因此,本研究選擇NH3·H2O-NH4Cl溶液為底液. 2.3.3 底液初始pH 考察了底液初始pH對電催化還原氯霉素的影響,獲得如圖 4所示的結果. 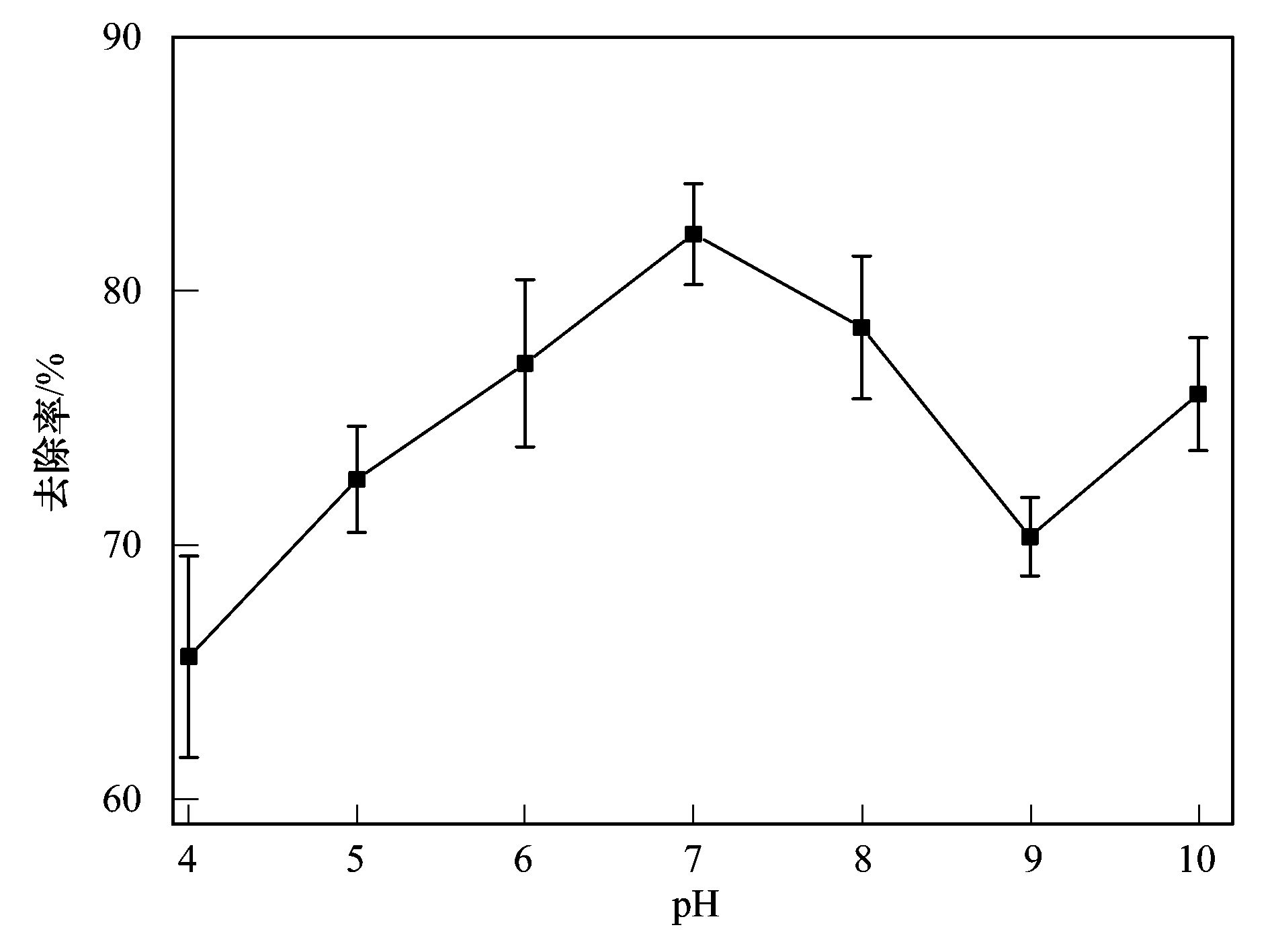 圖 4 底液初始pH對電催化還原氯霉素的影響 從圖 4可以看出,隨著(zhù)底液初始pH的增加,氯霉素的去除率逐漸增大; 在pH為7時(shí),獲得最大去除率為82.25%,隨后逐漸減小; 當pH為9時(shí),去除率下降為70.33%. 總體來(lái)看,酸性或堿性條件均不利于氯霉素的電催化還原. 在pH為10時(shí)氯霉素的去除率又開(kāi)始上升,這是因為在pH>9后氯霉素容易發(fā)生水解[26],導致其還原率出現假性增大. Zhuang等[27]在用循環(huán)伏安法測定氯霉素時(shí),也發(fā)現其還原峰電流在pH為7時(shí)達到最大,說(shuō)明中性環(huán)境更有利于電子傳導. 因此,本研究確定底液的初始pH為7. 在最優(yōu)的實(shí)驗條件下,考察了碳納米管修飾電極對氯霉素的電催化還原能力,獲得初始濃度為1、 2、 5和10 mg·L-1的氯霉素被還原12 h時(shí)的去除率分別為89.93%、 82.25%、 72.31%和67.36%,隨著(zhù)氯霉素濃度的增加,傳質(zhì)阻力相應增大,使得氯霉素的去除率下降. 該修飾電極通過(guò)去鈍化處理后,還原1 mg·L-1氯霉素12 h時(shí)的去除率能夠達到80%以上,說(shuō)明該電極特別適合于處理低濃度氯霉素廢水. 2.4 電催化還原氯霉素的動(dòng)力學(xué)特征 反應液中氯霉素濃度隨時(shí)間的變化如圖 5所示. 從中可以看出,氯霉素濃度隨時(shí)間的增加逐漸減小,在0~10 h時(shí)表現為快速還原過(guò)程,10~18 h表現為慢速還原過(guò)程,隨后趨于穩定; 獲得還原氯霉素24 h時(shí)的去除率為97.21%,遠遠高于在裸GCE上的去除率(53.69%),表明采用碳納米管修飾電極能夠顯著(zhù)提高氯霉素的去除率. 比較發(fā)現,本研究獲得氯霉素的去除率遠大于其在非生物陰極上還原24 h時(shí)的去除率(57.9%)[18]; 通過(guò)接種微生物的生物陰極還原氯霉素,24 h時(shí)氯霉素的去除率可以提高到96.0%[19],還是低于本研究的去除效果. 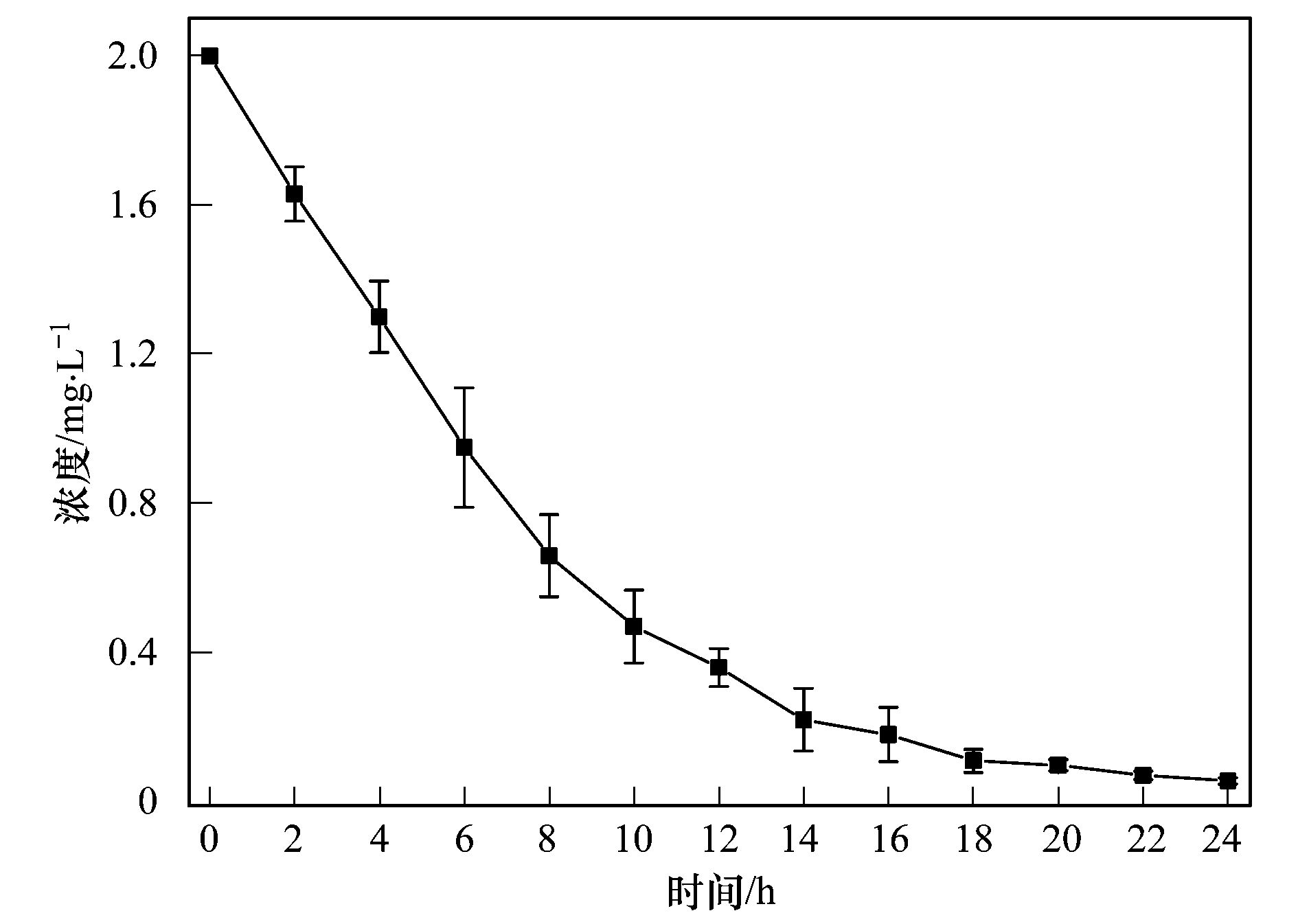 圖 5 電催化還原氯霉素的動(dòng)力學(xué)曲線(xiàn) 采用零級、 一級和二級反應動(dòng)力學(xué)模型擬合實(shí)驗數據,獲得如表 1所示的結果. 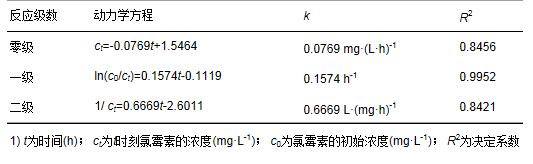 表 1電催化還原氯霉素的動(dòng)力學(xué)特征1) 從表 1可以看出,采用一級反應動(dòng)力學(xué)模型可以很好地描述氯霉素的電催化還原過(guò)程,獲得去除速率常數為0.1574 h-1,半衰期為4.40 h. Liang等[19]用非生物陰極、 Sun等[28]用生物陰極還原氯霉素也遵循一級反應動(dòng)力學(xué)方程,分別獲得的非生物陰極還原的速率常數(0.052 h-1)和生物陰極還原的速率常數(0.084 h-1)均明顯低于本研究,說(shuō)明采用碳納米管修飾電極能夠明顯加快氯霉素的還原. 2.5 電催化還原氯霉素的機制分析 取電催化還原氯霉素0和24 h的反應液,采用液相色譜-串聯(lián)質(zhì)譜法(LC-MS/MS)鑒定反應產(chǎn)物,獲得如圖 6所示的結果. 從圖 6可以看出,還原氯霉素(CAP)0 h時(shí),在質(zhì)譜中發(fā)現峰強度最高的氯霉素特征峰(質(zhì)荷比為321.1) 與生物陰極還原氯霉素的報道[4, 19, 29]吻合;還原氯霉素24 h時(shí),出現了峰強度較低的質(zhì)譜峰(質(zhì)荷比為294.6) 和峰強度最高的特征峰(質(zhì)荷比為261.2) ,分別被鑒定為羰基還原的AMCl2、 脫去1個(gè)氯原子的羰基還原的AMCl. 在用生物陰極還原氯霉素的產(chǎn)物中也得到類(lèi)似結果,鑒定出羰基還原的AMCl2(48 h)和脫去2個(gè)氯原子的羰基還原的AM(144 h)[29],本研究采用碳納米管修飾電極和更負的偏壓(-1.1 V)加快了氯霉素的還原進(jìn)程,隨著(zhù)時(shí)間的推移,羰基還原的AMCl可能會(huì )進(jìn)一步脫去另1個(gè)氯原子. 在非生物陰極還原氯霉素的產(chǎn)物中,除發(fā)現羰基還原的AMCl2外,還鑒定出具有強抗菌活性的中間產(chǎn)物亞硝基和羥氨基化合物(—NO2分別被還原為—NO和—NHOH)[30],當偏壓為-0.4 V時(shí)羰基還原的AMCl2難以進(jìn)一步脫氯轉化為羰基還原的AMCl,而在-0.7 V時(shí)容易進(jìn)一步脫氯轉化為羰基還原的AMCl[19],很好地解釋了本研究在-1.1 V電催化還原氯霉素鑒定出羰基還原的AMCl[圖 6(b)]的事實(shí),未發(fā)現亞硝基和羥氨基化合物的原因可能是還原24 h時(shí)這些中間產(chǎn)物已經(jīng)被完全轉化. 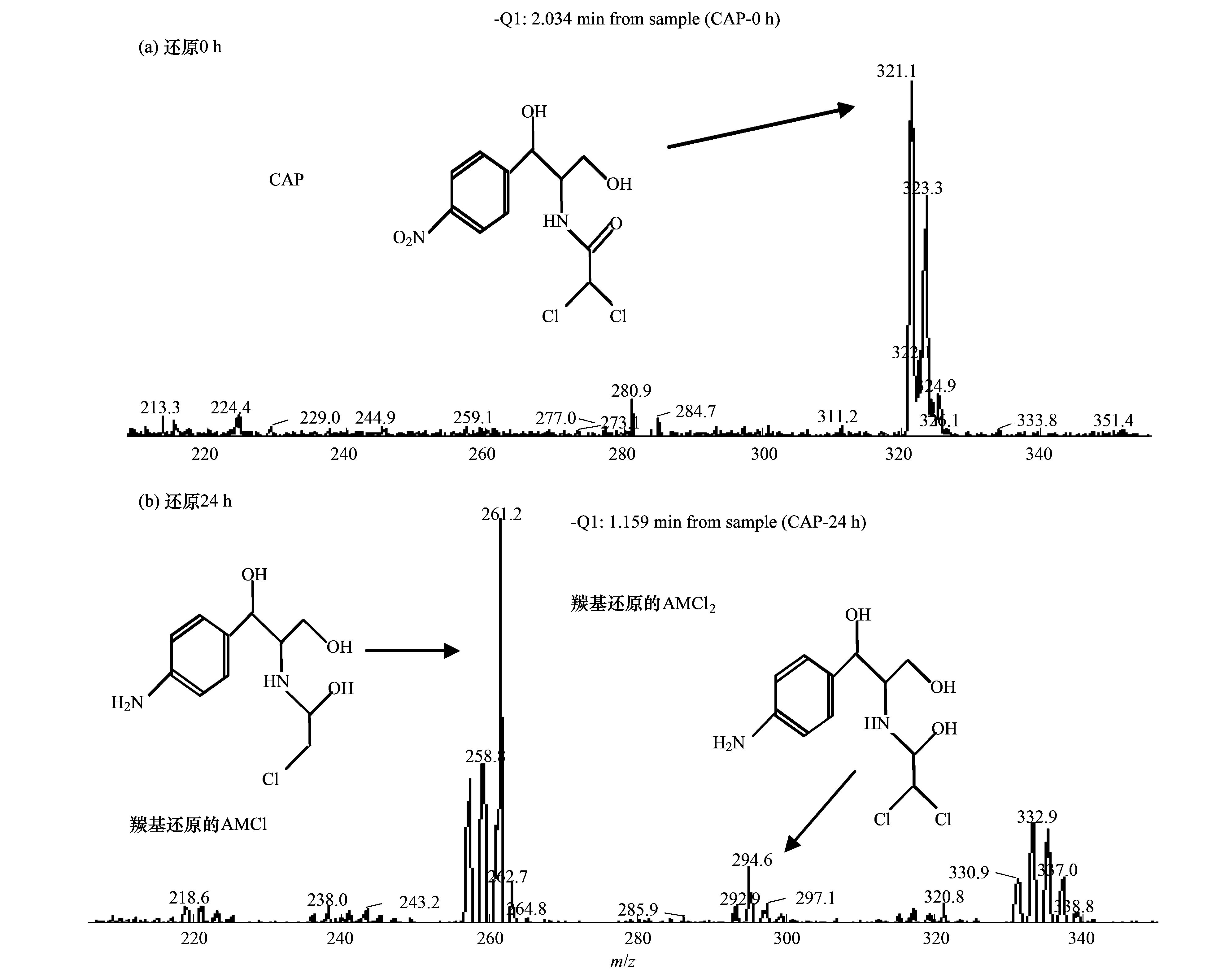 圖 6 氯霉素還原產(chǎn)物鑒定 基于以上分析,獲得電催化還原氯霉素的可能途徑(見(jiàn)圖 7). 從中可以看出,在碳納米管修飾電極電催化還原過(guò)程中,氯霉素獲得2、 4、 6、 8和10個(gè)電子,被分別轉化為亞硝基化合物、 羥氨基化合物、 AMCl2、 羰基還原的AMCl2和羰基還原的AMCl,由于生成羰基還原的AMCl2和羰基還原的AMCl,不僅還原了氯霉素中決定抗菌性的硝基基團[31],還可以進(jìn)一步還原羰基和脫氯,顯著(zhù)降低氯霉素的毒性. 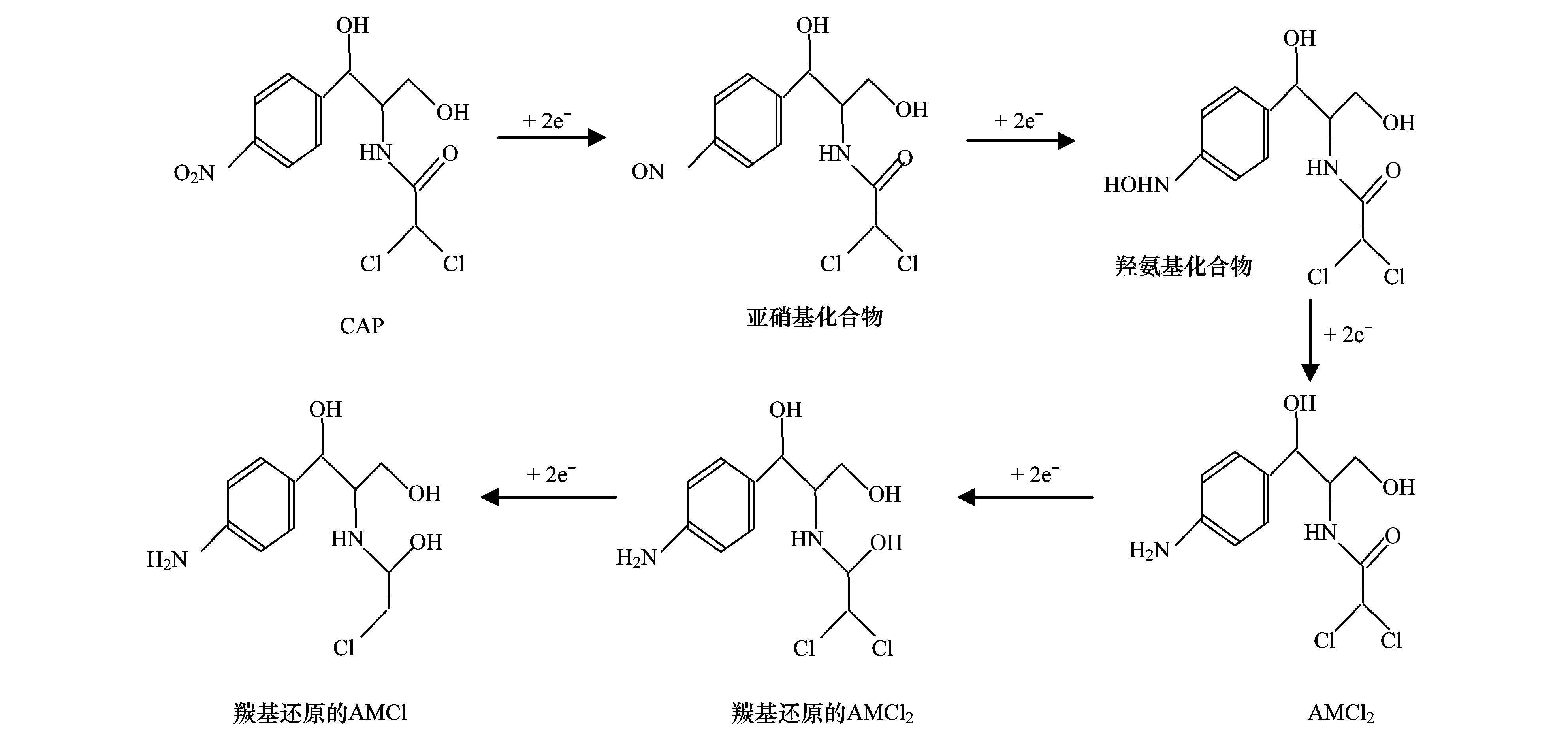 圖 7 電催化還原氯霉素的可能途徑 3 結論 (1) 獲得了碳納米管修飾電極的最佳制備條件,即采用DHP輔助分散碳納米管,MWCNTs和DHP的配比為1∶1,分散液修飾量為15 μL; 獲得了電催化還原氯霉素的最佳條件,即偏壓為-1.1 V,底液為0.1 mol·L-1 NH3·H2O-NH4Cl溶液,初始pH為7. (2) 電催化還原氯霉素的動(dòng)力學(xué)過(guò)程符合一級反應動(dòng)力學(xué)模型,去除速率常數為0.1574 h-1; 氯霉素被還原24 h的去除率達到97.21%,特別適合于低濃度氯霉素廢水的處理. (3) 采用碳納米管修飾電極電催化還原氯霉素,不僅還原了氯霉素中決定抗菌性的硝基基團,還可以進(jìn)一步還原羰基和脫氯,顯著(zhù)降低氯霉素的毒性. |

