|
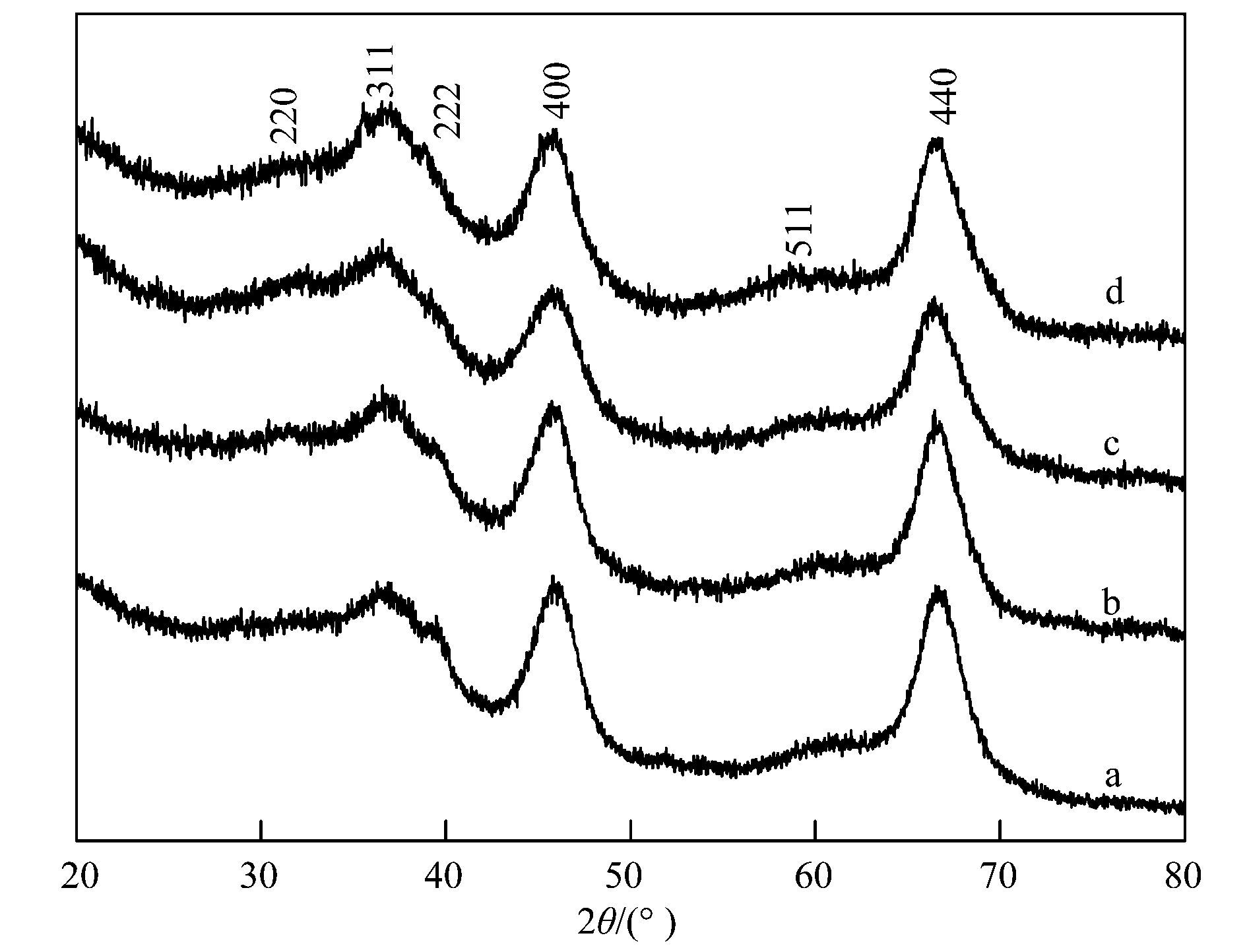
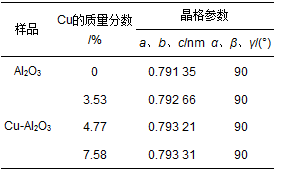
工業(yè)廢水及飲用水中有機污染物催化去除機制作為高級催化氧化技術(shù)的一種,芬頓氧化法由于能夠快速產(chǎn)生高濃度的羥基自由基(·OH),通常作為生物氧化的前處理或后處理單元技術(shù)應用于難降解工業(yè)廢水處理和飲用水深度凈化.均相芬頓反應雖然催化效率較高,但進(jìn)出水不僅需要大量的酸堿調節pH,而且處理過(guò)程中產(chǎn)生大量的鐵泥,不僅造成二次污染,還使廢水處理成本大幅度提高.而非均相芬頓反應由于可以克服這些缺點(diǎn)而逐漸引起研究者的廣泛關(guān)注.非均相芬頓催化反應的關(guān)鍵是高效穩定催化劑的研發(fā).目前國內外所研制的非均相芬頓催化劑多是含鐵的固相催化劑,如鐵氧化物和金屬復合氧化物、鐵離子或鐵氧化物負載于分子篩、黏土、碳材料等.這些非均相芬頓催化劑在pH 4~5的條件下,實(shí)現了Fe (Ⅱ)/Fe (Ⅲ) 循環(huán),減少了污泥的產(chǎn)生,提高了催化效率.但是在pH>6,水體通常酸堿條件下,Fe (Ⅲ) 難以被H2O2還原為Fe (Ⅱ),其速率常數僅為0.001~0.02 L·(mol·s)-1,限制了芬頓反應速率,通常需要光、電、超聲等外能輔助.根據已有報道,Cu+可以催化H2O2分解產(chǎn)生羥基自由基(·OH),其反應速率常數為4.1×103 L·(mol·s)-1比Fe2+與H2O2反應的速率常數76 L·(mol·s)-1高將近2個(gè)數量級,而且Cu2+可以與H2O2作用轉化為Cu+,其反應速率常數為460 L·(mol·s)-1,遠遠高于Fe3+還原返回到Fe2+的速率常數,所以Cu+/Cu2+較容易循環(huán).但是,Cu+在水中的不穩定性限制了其應用. Cu+和Cu2+的固定化是銅基芬頓催化劑應用的關(guān)鍵.國內外對銅基多相芬頓催化劑的研發(fā)已經(jīng)取得了一些進(jìn)展,主要包括兩種類(lèi)型:一類(lèi)是復合氧化物,如CuFeO2、Cu摻雜αFeOOH、CuFe2O4等.另一類(lèi)是銅離子或銅氧化物負載于金屬氧化物、分子篩(如Y和SBA-15)、黏土、活性炭等.目前所報道的這些含銅類(lèi)芬頓催化劑的結構中銅主要以Cu2+離子或者氧化銅的形式存在,雖然實(shí)現了在近中性溫和條件下進(jìn)行催化反應,但是仍然存在銅離子溶出嚴重、H2O2無(wú)效分解產(chǎn)生氧氣的問(wèn)題,導致催化效率低,H2O2消耗量過(guò)大.有研究發(fā)現Cu+和Cu2+可以穩定地共存于LaTiO3結構中,在pH 4~9的范圍內對羅丹明B的脫色均顯示出較高的芬頓催化效率.其原因之一是催化劑結構中Cu+和Cu2+在常溫條件下易于發(fā)生循環(huán)反應,加速界面電子轉移,從而提高了芬頓反應效率和催化劑穩定性.本文針對水中難降解有機污染物的去除問(wèn)題,以酚類(lèi)化合物2-氯苯酚(2-chlorophenol,2-CP) 和染料羅丹明B (Rhodamine B,RhB) 為模型污染物,通過(guò)簡(jiǎn)單的共沉淀法將Cu2+和Cu+共同摻入Al2O3的骨架結構中,得到高活性高穩定性的非均相類(lèi)芬頓催化劑,系統地研究了其結構特征和催化特性,并提出了其催化反應機制. 1 材料與方法 1.1 實(shí)驗材料及試劑 三水硝酸銅,九水硝酸鋁,氨水(25%),2-氯苯酚(2-CP),過(guò)氧化氫(H2O2,質(zhì)量分數30%) 均購自國藥集團化學(xué)試劑有限公司;5-叔丁羧基-5-甲基-1-吡咯啉-N-氧化物(5-tert-butoxycarbonyl-5-methyl-1-pyrroline-N-oxide,BMPO) 來(lái)自于Sigma Aldrich公司;所有化學(xué)試劑至少是分析純. 1.2 催化劑的制備 Cu-Al2O3的制備如下:準確稱(chēng)取1.88 g九水硝酸鋁和0.12 g三水硝酸銅,溶于去離子水.逐滴加入氨水(25%),調pH至9.0,80℃水浴攪拌過(guò)夜,然后離心,水洗3次,干燥,得到的材料在500℃空氣條件下煅燒4 h,得到綠色的Cu-Al2O3樣品.此外,利用硝酸和氫氟酸溶解材料,然后通過(guò)電感耦合等離子體發(fā)射光譜儀(ICP-OES,OPTIMA 2000 Perkin Elmer Co.) 測定材料中銅的含量,計算得到此制備過(guò)程所得催化劑中銅的質(zhì)量分數約為4.77%.通過(guò)改變銅鹽的投加量,可制備得到不同Cu摻雜量的Cu-Al2O3.為了對比,在不加銅鹽的情況下,制備得到純Al2O3. 1.3 催化劑的表征 采用Scintag-XDS-2000型X射線(xiàn)衍射儀測定了催化劑的晶體結構;采用英國Kratos公司AXIS Ultra X射線(xiàn)光電子能譜(XPS) 對Cu-Al2O3表面各元素形態(tài)及含量進(jìn)行分析;Cu的K邊(8.979 keV) 擴展X射線(xiàn)吸收精細結構(EXAFS) 譜圖采用上海光源同步輻射裝置(SSRF) 在室溫光束傳輸模式(BL14W1) 下測定;采用Hitachi U-3900型紫外-可見(jiàn)分光光度計測定固體催化劑的紫外可見(jiàn)漫反射吸收光譜. 1.4 催化劑類(lèi)芬頓催化降解有機污染物 以2-CP和RhB為目標物考察所制備樣品的類(lèi)芬頓催化性能. ①對2-CP的降解:室溫下將0.07 g催化劑加入到50 mL濃度為10 mg·L-1的2-CP溶液中,于暗處攪拌20 min,使其達到吸附平衡.然后加入20 mmol·L-1 H2O2,進(jìn)行類(lèi)芬頓催化降解.溶液初始pH=6.5,由于整個(gè)反應過(guò)程中pH基本不發(fā)生變化,因此反應過(guò)程中不調節溶液pH.每隔固定時(shí)間取樣,經(jīng)0.45 μm的濾膜過(guò)濾,然后用高效液相色譜儀(1 200 series;Agilent) 測定2-CP的濃度.測定條件為: Zorbax SB-Aq柱(5 μm,4.6×250 mm;Agilent),檢測波長(cháng)為275 nm;流動(dòng)相為甲醇:水(60:40),進(jìn)樣量為20 μL,流速為1.0 mL·min-1. ②對RhB的降解:室溫下將0.025 g催化劑加入到50 mL濃度為5 mg·L-1的RhB溶液中,暗吸附20 min后,加入10 mmol·L-1 H2O2,進(jìn)行類(lèi)芬頓催化降解,反應過(guò)程中不調節溶液pH.每隔固定時(shí)間取樣,離心后立即用紫外可見(jiàn)光譜儀(Hitachi U3900) 在最大吸收波長(cháng)處測定其濃度.總有機碳(TOC) 用TOC-VCPH(Shimadzu) 總有機碳分析儀測定.使用電感耦合等離子體發(fā)射光譜儀(ICP-OES,OPTIMA 2000 Perkin Elmer Co.) 分析反應過(guò)程中溶液里金屬離子的濃度. 2 結果與討論 2.1 催化劑的表征 通過(guò)簡(jiǎn)單的共沉淀法制備得到一系列銅摻雜鋁氧化物催化劑,圖 1為不同樣品的X射線(xiàn)衍射(XRD) 圖譜.不同銅含量的催化劑樣品Cu-Al2O3 (Cu所占質(zhì)量分數:3.53%、4.77%、7.58%) 的衍射峰與未摻雜鋁氧化物具有相同的晶型結構,根據X射線(xiàn)衍射標準譜圖對比可知,所制備樣品Al2O3和不同銅含量的Al2O3均顯示γ-Al2O3(JCPDS 29-0063) 晶相的(220)、(311)、(222)、(400)、(511) 和(440) 的特征衍射峰,且沒(méi)有含銅或銅氧化物雜峰的出現,這可能由于銅物種在A(yíng)l2O3表面分散性良好、以無(wú)定形形態(tài)存在或者取代Al進(jìn)入Al2O3結構中.此外,如表 1所示,隨著(zhù)Al2O3中銅的質(zhì)量分數增加到4.77%,樣品的晶格參數明顯地增加,而當銅的質(zhì)量分數進(jìn)一步增加到7.58%時(shí),晶格參數僅略微增加.由于Cu2+或Cu+的離子半徑均比Al3+大,以上晶格參數的明顯增加說(shuō)明Cu取代Al進(jìn)入Al2O3的晶格中,暗示Al-O-Cu鍵在Cu-Al2O3中的形成.而晶格參數的略微增加說(shuō)明銅含量高于4.77%的部分幾乎沒(méi)有取代Al進(jìn)入晶格結構中.
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 圖 1 不同催化劑的XRD譜圖
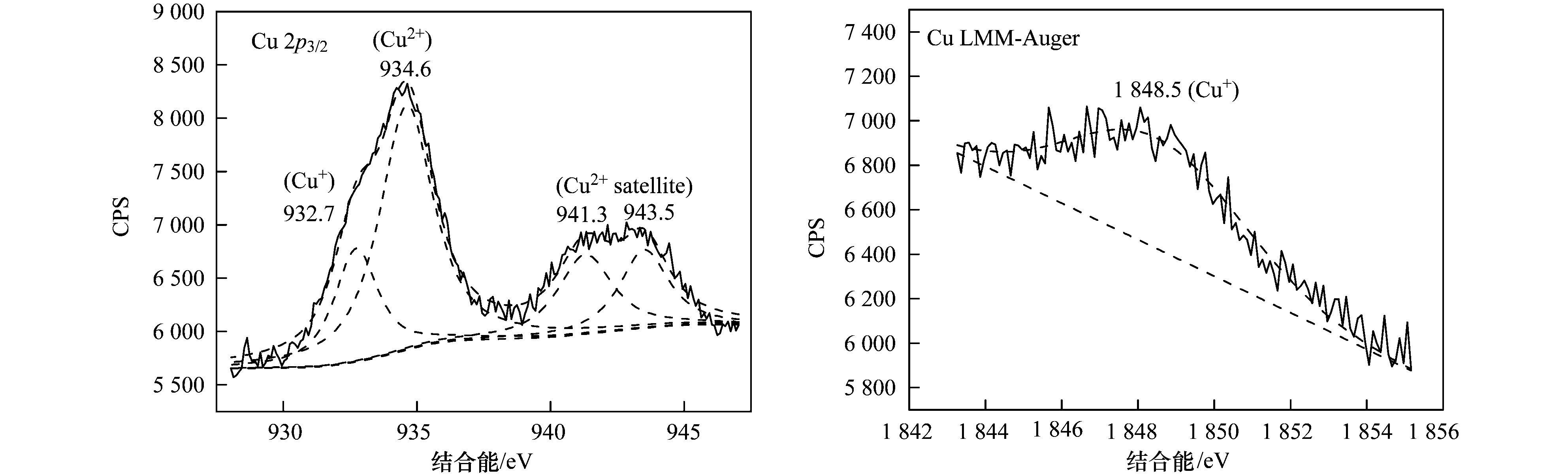
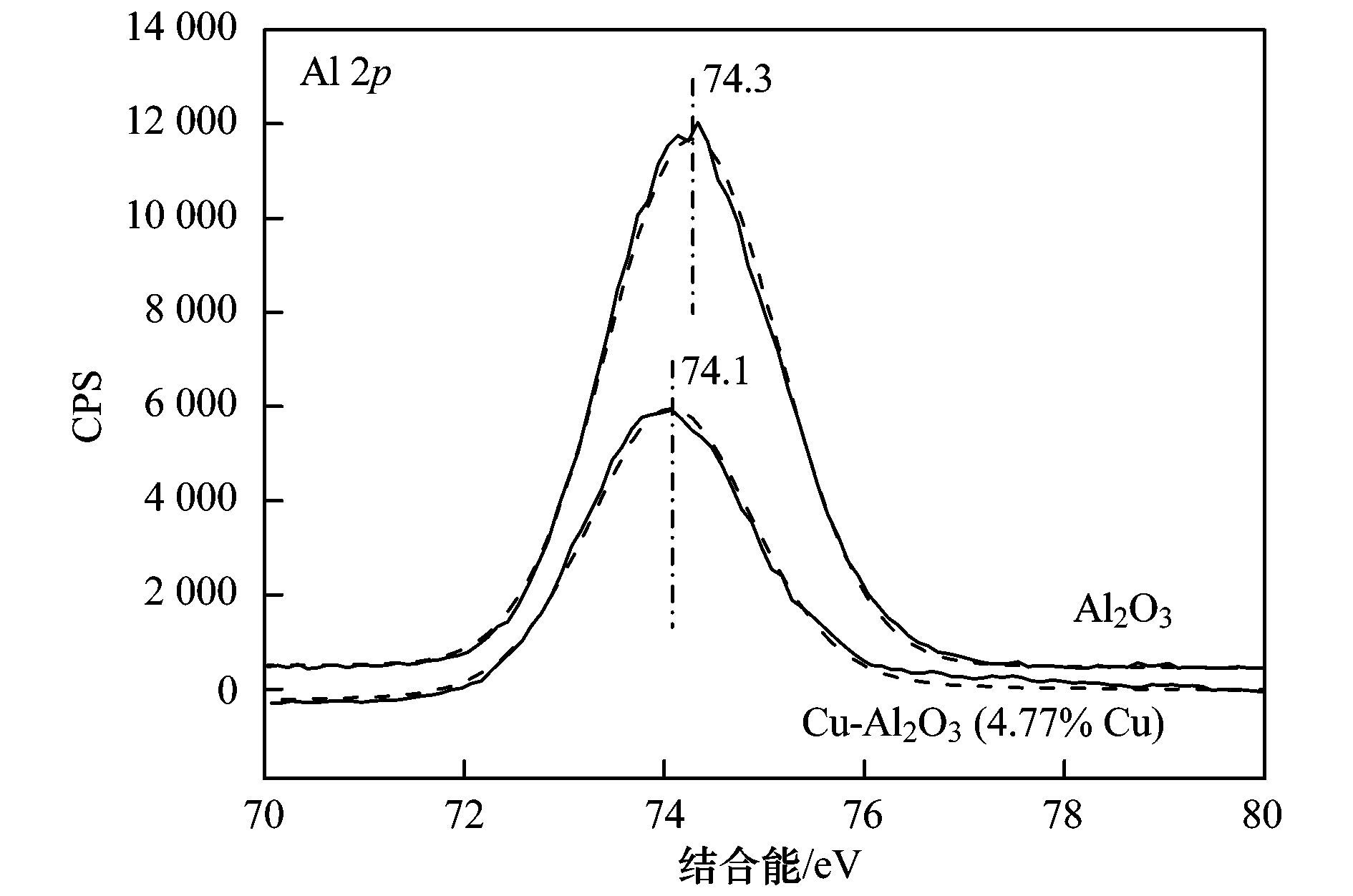
表 1 不同樣品的晶格參數 進(jìn)一步通過(guò)XPS分析了Cu-Al2O3表面元素形態(tài),見(jiàn)圖 2. Cu-Al2O3 (4.77% Cu) 的Cu 2p3/2光電子能譜可以利用XPS分峰軟件進(jìn)行擬合分峰,由分峰譜可以看出,該催化劑表面存在Cu2+(934.6 eV) 和低價(jià)Cu (932.7 eV). Cu2+也可以由941.3~943.5 eV范圍的伴峰來(lái)確定.由于低價(jià)Cu物種(即Cu0或Cu+) 的結合能很相近,因此它們難以由單一的XPS數據來(lái)確定,而需要由俄歇參數來(lái)分辨還原性Cu物種.通過(guò)俄歇電子能譜(AES) 進(jìn)行進(jìn)一步的測定,俄歇參數為1 848.5 eV證實(shí)Cu+的存在.催化劑表面Cu2+和Cu+的原子比約為2.64:1.此外,根據XPS分析結果,表面Cu/Al原子比為1/19.5,略高于體相Cu/Al原子比(1/24.1),這說(shuō)明Cu-Al2O3 (4.77% Cu) 中銅比較均勻地分散于體相中,即Cu很可能部分取代Al進(jìn)入Al2O3晶格中.如圖 3所示,進(jìn)一步從Al2O3的Al 2p XPS譜圖中可以看出,Al 2p的結合能為74.3 eV,歸屬于A(yíng)l-O-Al中Al3+的特征峰;當Cu引入Al2O3后,Al 2p的結合能降低為74.1 eV,說(shuō)明Al周?chē)逆I合環(huán)境發(fā)生了變化,預示Al-O-Cu鍵的形成.不同樣品中Cu的K邊傅里葉變換EXAFS信號圖如圖 4所示. Cu-Al2O3 (4.77% Cu) 樣品中出現了兩個(gè)殼層,其中一個(gè)殼層在0.144 nm附近,歸屬于Cu-O殼層.另一個(gè)殼層位于0.268 nm,比CuO (0.244 nm) 和Cu2O (0.255 nm) 中的Cu-Cu殼層都長(cháng),說(shuō)明該殼層歸屬于Cu-Al殼層,即Cu-Al2O3 (4.77% Cu) 中形成了Al-O-Cu鍵.
圖 2 Cu-Al2O3 (4.77% Cu) 表面Cu的XPS譜圖
圖 3 Al2O3和Cu-Al2O3 (4.77% Cu) 表面Al的XPS譜圖
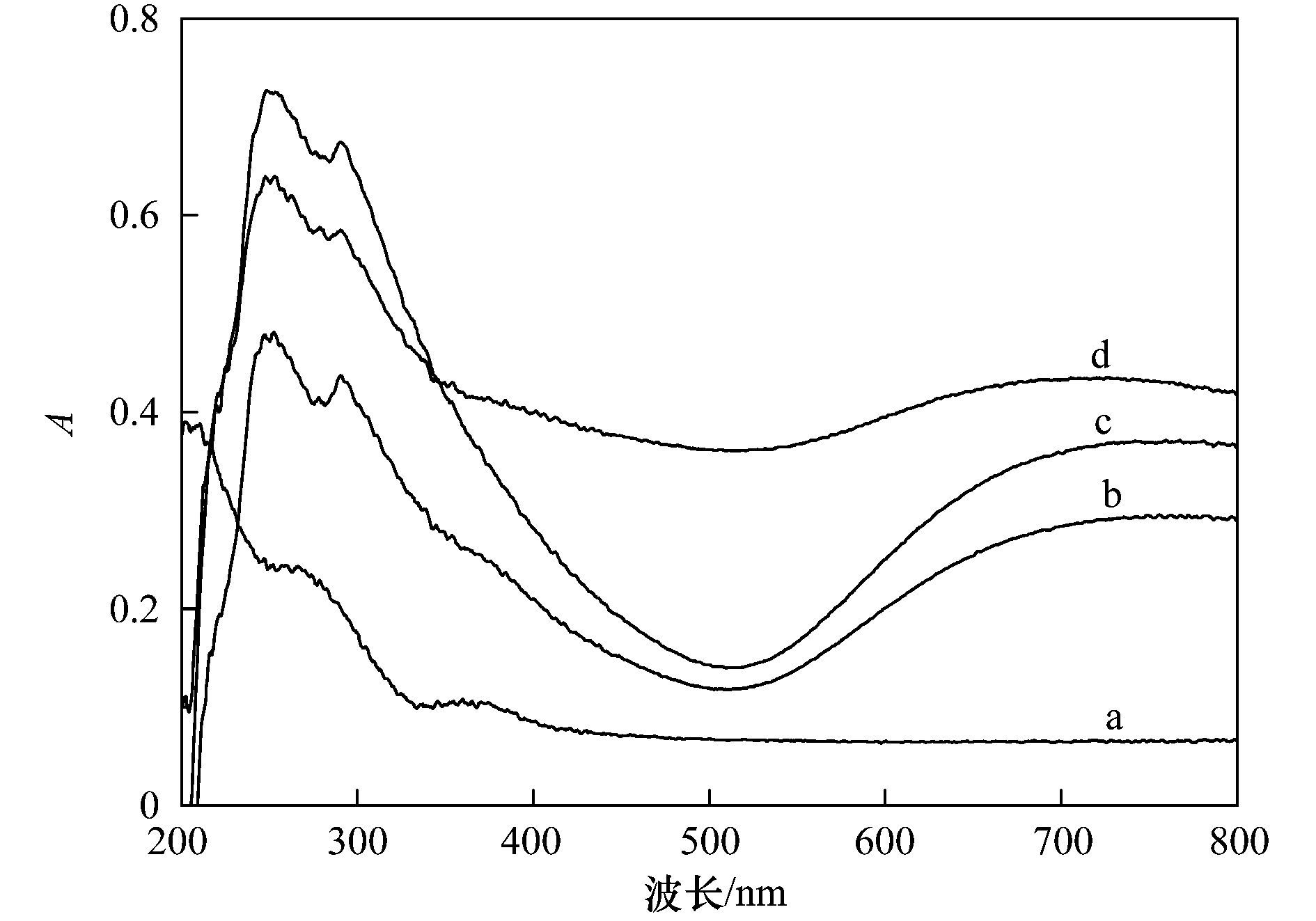
圖 4 不同樣品的Cu K邊EXAFS傅里葉變換譜圖 另外,銅在Cu-Al2O3中的形態(tài)通過(guò)UV-vis DRS進(jìn)一步地測定(圖 5).與未摻雜的Al2O3相比,Cu-Al2O3在750 nm左右出現一個(gè)明顯的吸收帶,這是Cu2+在尖晶石晶格八面體位點(diǎn)的電子轉換產(chǎn)生的,說(shuō)明銅摻雜進(jìn)入了Al2O3晶格,進(jìn)一步說(shuō)明了Al-O-Cu鍵的形成.此外,Cu-Al2O3 (7.58% Cu) 在520 nm左右的紫外可見(jiàn)吸收明顯增加,這是外骨架銅聚物或者銅氧化物團簇存在導致的,說(shuō)明過(guò)量的Cu摻雜致使催化劑中外骨架銅氧化物的存在.
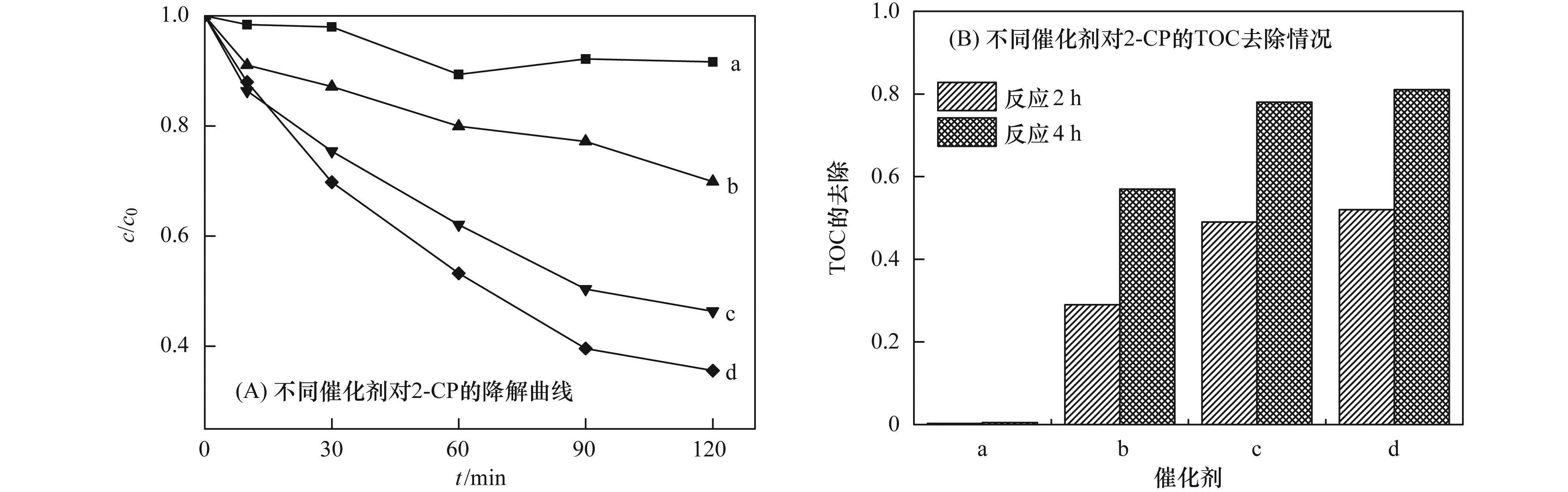
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 圖 5 不同催化劑的UV-vis DRS譜圖 2.2 Cu-Al2O3類(lèi)芬頓催化降解有機污染物的活性及穩定性 催化劑的催化活性和穩定性是評價(jià)催化劑催化性能的兩個(gè)主要因素. 圖 6顯示了不同催化劑對2-CP的催化降解和礦化情況.從中可以看出,在H2O2存在下,未摻雜的Al2O3對2-CP幾乎無(wú)降解作用.隨著(zhù)Cu摻雜量的增加,催化劑的催化活性呈現逐漸增加的趨勢,催化反應120 min,對2-CP底物的去除率由Cu-Al2O3 (3.53% Cu) 的30%提高到Cu-Al2O3 (4.77% Cu) 的54%,而繼續增加Cu的摻雜量,催化活性的增加變緩,Cu-Al2O3 (7.58% Cu) 對2-CP底物的去除率約為64%. Cu摻雜量對催化劑礦化活性的影響呈現同樣的趨勢,反應2 h,Cu-Al2O3 (3.53%,4.77%,7.58% Cu) 對2-CP的TOC去除率分別為29%、49%和52%,進(jìn)一步反應4 h,TOC去除率可分別達到57%、78%和81%.對比反應2 h內2-CP底物和TOC的去除率,可以看出Cu-Al2O3 (3.53%,4.77% Cu) 幾乎能夠同步去除2-CP底物和TOC,說(shuō)明骨架銅物種對2-CP具有顯著(zhù)地礦化效果,而Cu-Al2O3 (7.58% Cu) 中外骨架銅物種的存在對2-CP底物去除具有一定的效果,而對TOC的去除效果不顯著(zhù).
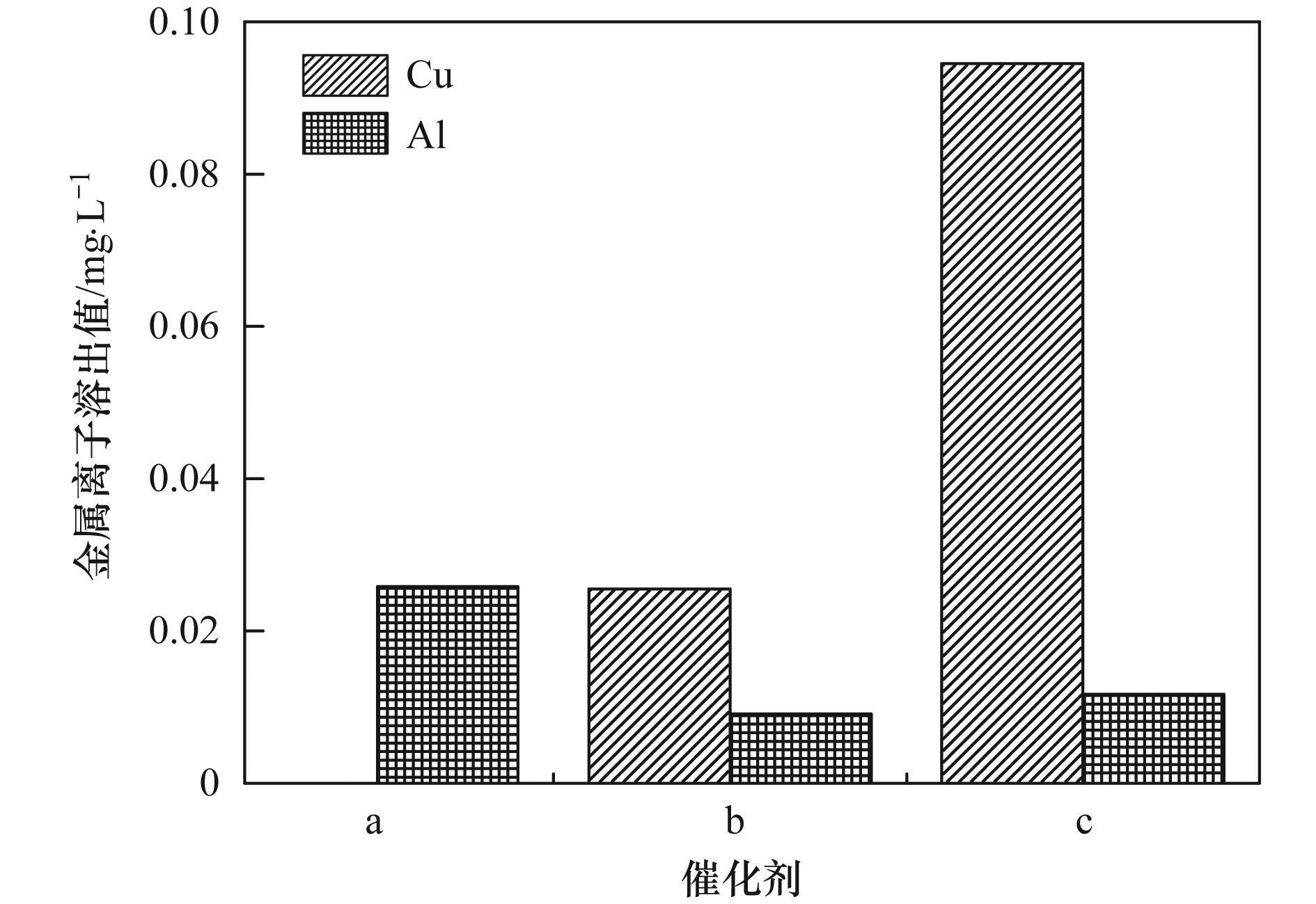
a. Al2O3;b. Cu-Al2O3 (3.53% Cu);c. Cu-Al2O3 (4.77% Cu);d. Cu-Al2O3 (7.58% Cu) 圖 6 Cu摻雜量對催化劑類(lèi)芬頓催化降解和礦化2-CP的影響 反應過(guò)程中金屬離子的溶出是評價(jià)催化劑穩定性的一個(gè)重要因素. 圖 7考察了不同催化劑Cu-Al2O3 (3.53%、4.77%、7.58% Cu) 催化降解2-CP反應2 h后的金屬溶出情況.從中可知,在反應過(guò)程中不同催化劑的鋁溶出量很少,可以忽略不計.而隨著(zhù)催化劑中Cu摻雜量的增加,催化劑的銅溶出量逐漸增加,Cu-Al2O3 (3.53% Cu) 在反應過(guò)程中沒(méi)有檢測到銅離子溶出,反應2 h后,Cu-Al2O3 (4.77% Cu) 的反應溶液中銅離子濃度約為0.0255 mg·L-1,而Cu-Al2O3 (7.58% Cu) 體系中銅離子溶出量約為0.0945 mg·L-1.
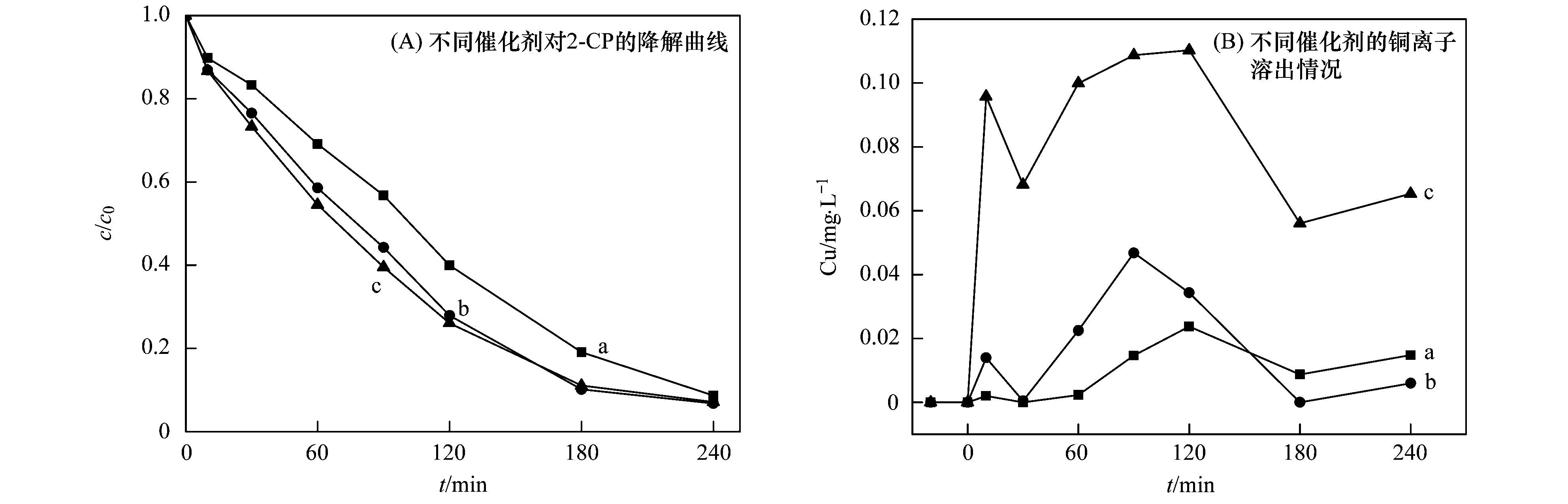
a. Cu-Al2O3 (3.53% Cu);b. Cu-Al2O3 (4.77% Cu);c. Cu-Al2O3 (7.58% Cu) 圖 7 Cu摻雜量對催化劑穩定性的影響 類(lèi)似地,不同催化劑Cu-Al2O3 (3.53%、4.77%、7.58% Cu) 催化降解水中染料RhB的實(shí)驗也證明相比Cu-Al2O3 (3.53%和7.58% Cu),Cu-Al2O3 (4.77% Cu) 具有較高的催化活性和較低的銅離子溶出(見(jiàn)圖 8).由此可以確定Cu的最佳摻雜量為4.77%. Cu-Al2O3催化劑的結構表征已經(jīng)表明Cu-Al2O3 (3.53%,4.77% Cu) 中Cu主要以骨架銅的形式存在,而過(guò)量的Cu摻雜,如Cu-Al2O3 (7.58% Cu),將導致外骨架銅物種的存在,這也是催化活性增加減慢和穩定性下降的主要原因.
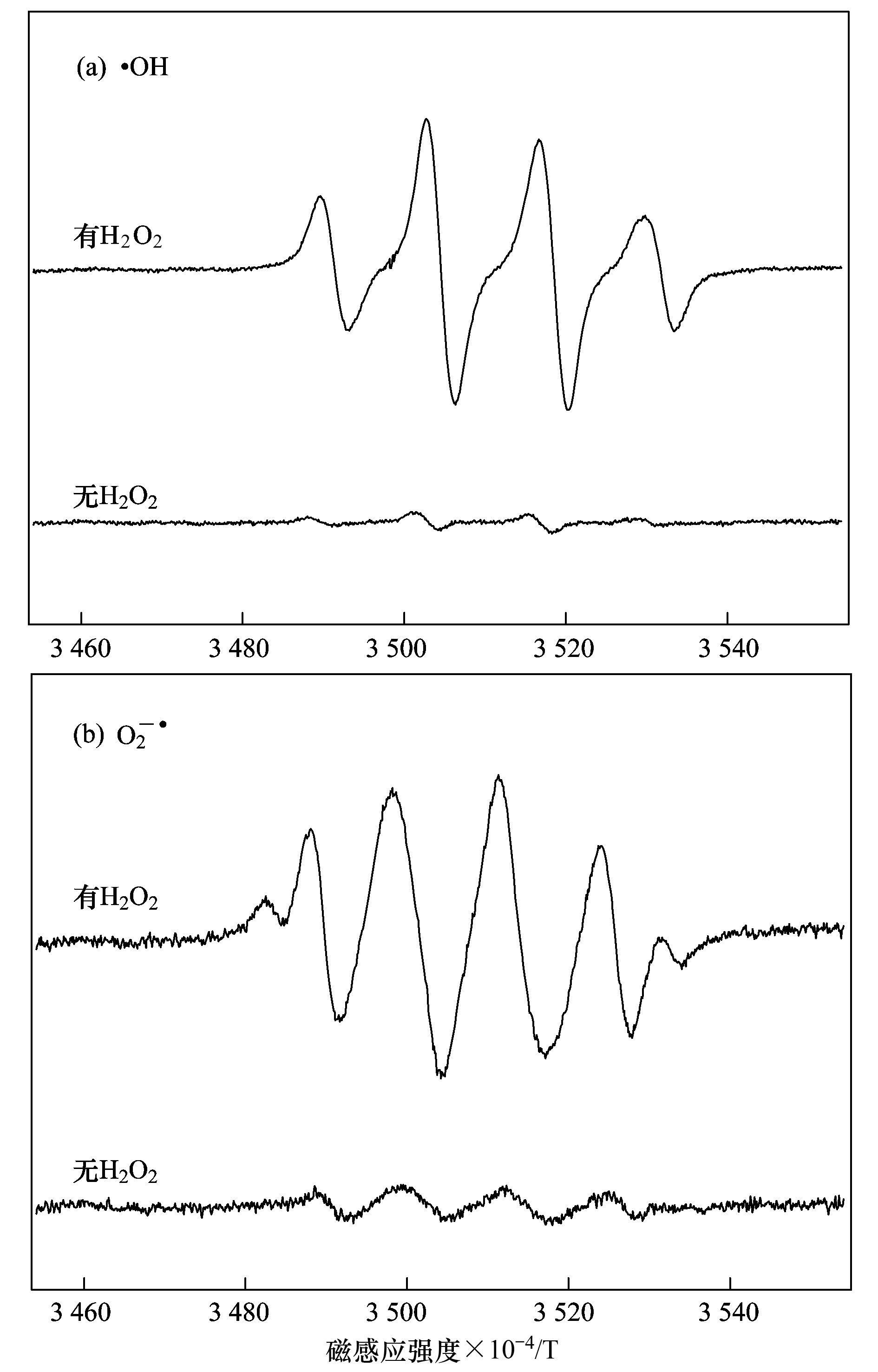
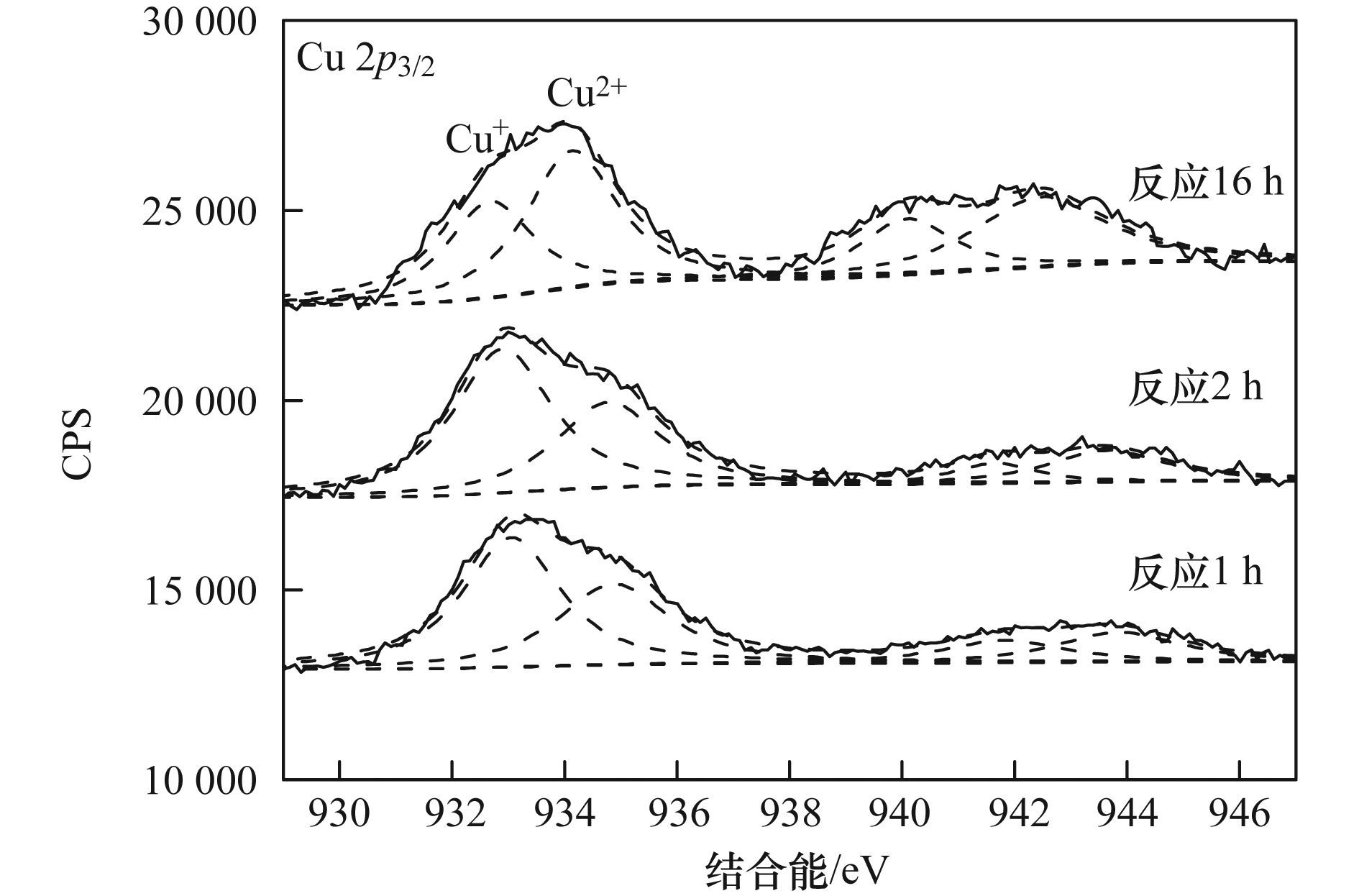
a. Cu-Al2O3 (3.53% Cu);b. Cu-Al2O3 (4.77% Cu);c. Cu-Al2O3 (7.58% Cu) 圖 8 Cu摻雜量對催化劑類(lèi)芬頓催化降解RhB活性和穩定性的影響 2.3 Cu-Al2O3的類(lèi)芬頓催化機制 ESR是測定短壽命自由基的一種非常有效的現代分析技術(shù),其測定信號有助于理解芬頓催化反應機理.本實(shí)驗中使用不飽和的抗磁性物質(zhì)BMPO自旋捕捉劑與自由基生成壽命較長(cháng)的自旋加合物而間接進(jìn)行自由基的測定.如圖 9所示,在沒(méi)有加入H2O2的條件下,幾乎沒(méi)有自由基特征信號峰的生成,加入H2O2,在水體系中,出現典型的BMPO-·OH加合物信號1:2:2:1的四重峰. HO2-/O2-·在水溶液中不穩定[20],所以在甲醇體系中進(jìn)行HO2·的ESR測定.由圖 9中可以看出,H2O2存在體系的ESR波譜中檢測到BMPO-HO2-/O2-·加合物的特征峰.活性氧物種的測定結果表明催化劑Cu-Al2O3 (4.77% Cu) 將H2O2分解成高活性的·OH和HO2-/O2-·自由基.此外,根據XPS分析(圖 10),反應1、2 h和16 h后,Cu-Al2O3 (4.77% Cu) 表面Cu2+和Cu+的原子比分別為0.71:1、0.62:1和1.47:1,相比反應前催化劑表面Cu2+和Cu+的原子比2.64:1,可以看出反應過(guò)程中Cu2+迅速地還原為Cu+,最終Cu+又轉化回Cu2+,此外,根據催化劑的表征結果,Cu2+和Cu+在A(yíng)l2O3骨架結構中共存,而且催化反應后催化劑的銅離子溶出量非常低,說(shuō)明催化劑在與H2O2相互作用的過(guò)程中,骨架銅物種Cu2+和Cu+能夠快速地發(fā)生循環(huán)反應,加速電子轉移,從而獲得較高的芬頓催化效率和穩定性.
圖 9 Cu-Al2O3 (4.77% Cu)/H2O2體系中·OH和HO2-/O2-·的生成情況
圖 10 反應后Cu-Al2O3 (4.77% Cu) 表面Cu的XPS譜圖 3 結論 (1) 通過(guò)簡(jiǎn)單的共沉淀法制備了Cu摻雜的Al2O3類(lèi)芬頓催化劑.結構表征結果表明銅主要以Cu2+和Cu+的形式共存于A(yíng)l2O3的骨架結構中. (2) 銅的摻雜提高了催化劑類(lèi)芬頓催化降解活性,其最佳摻雜量為4.77%;Cu-Al2O3中骨架銅的存在是提高催化活性和催化穩定性的主要原因. (3) Cu-Al2O3類(lèi)芬頓催化反應體系中,催化劑與H2O2相互作用,骨架銅物種Cu2+和Cu+能夠快速地發(fā)生循環(huán)反應,催化H2O2產(chǎn)生·OH和HO2-/O2-·. |